Internacionales
Las empresas farmacéuticas anunciaron que 4.000 mujeres forman parte de esta investigación para evaluar la seguridad, tolerabilidad e inmunogenicidad de su ensayo contra la enfermedad de COVID-19
Viernes 19 de Febrero de 2021
15:20 | Viernes 19 de Febrero de 2021 | La Rioja, Argentina | Fenix Multiplataforma
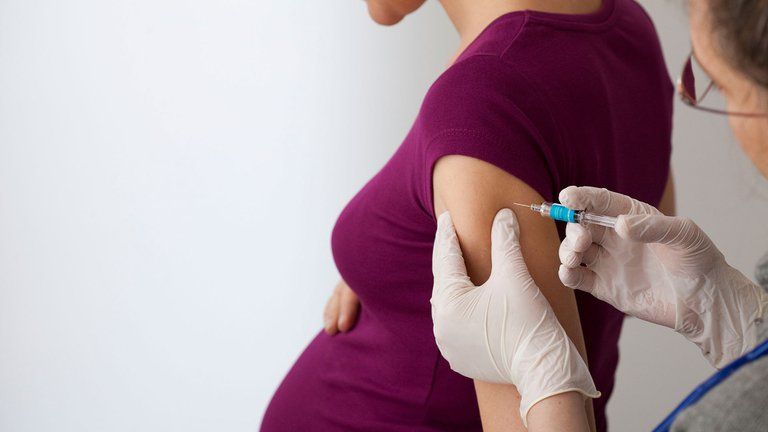
Pfizer y BioNTech anunciaron que han administrado la dosis de su vacuna contra el coronavirus a las primeras participantes embarazadas sanas en un estudio global de fase 2/3 para seguir evaluando la seguridad, tolerabilidad e inmunogenicidad de su ensayo contra la enfermedad de COVID-19 en mujeres que esperan bebés.
“Estamos orgullosos de iniciar este estudio en mujeres embarazadas y de seguir reuniendo las pruebas de seguridad y eficacia para apoyar potencialmente el uso de la vacuna por parte de subpoblaciones importantes. Las mujeres embarazadas tienen un mayor riesgo de complicaciones y de desarrollar COVID-19 grave, por lo que es fundamental que desarrollemos una vacuna que sea segura y eficaz para esta población. Estamos profundamente agradecidos a las voluntarias que se están inscribiendo en el ensayo y a los investigadores del centro que están dirigiendo este trabajo”, señaló el vicepresidente senior de Investigación y Desarrollo Clínico de Vacunas de Pfizer, William Gruber.
“Permitir un amplio acceso a nuestra vacuna COVID-19 de gran eficacia es un objetivo importante para nosotros. Ahora que estamos viendo el éxito de la implementación inicial de las campañas de vacunación en todo el mundo, es el momento de dar el siguiente paso y ampliar nuestro programa clínico a otras poblaciones vulnerables, como las mujeres embarazadas, para proteger potencialmente tanto a ellas como a las generaciones futuras”, agregó el director médico de BioNTech, Özlem Türeci.
El ensayo de fase 2/3 está diseñado como un estudio aleatorizado, controlado con placebo y ciego a los observadores en aproximadamente 4.000 mujeres embarazadas sanas de 18 años o más vacunadas durante las 24 a 34 semanas de gestación. El estudio evaluará la seguridad, tolerabilidad e inmunogenicidad de dos dosis de la vacuna o de placebo administradas con 21 días de diferencia. Cada mujer participará en el estudio durante aproximadamente 7 a 10 meses, dependiendo de si fue aleatorizada para recibir la vacuna o el placebo.
El estudio evaluará la seguridad en los bebés de las mujeres embarazadas vacunadas y la transferencia de anticuerpos potencialmente protectores a sus hijos. Los bebés serán controlados hasta aproximadamente los seis meses de edad. Como se establece en el protocolo del estudio, después de que nazca el bebé de una participante, las voluntarias en el ensayo materno serán desenmascaradas y las que estaban en el grupo de placebo recibirán la vacuna.
Antes de llevar a cabo su ensayo clínico en mujeres embarazadas, Pfizer y BioNTech completaron una investigación de toxicidad requerida por las autoridades reguladoras antes de iniciar este nuevo estudio, los cuales no mostraron ninguna evidencia de toxicidad para la fertilidad o la reproducción en los animales.
Pfizer y BioNTech esperan iniciar estudios adicionales en niños de entre 5 y 11 años “en los próximos meses”, y en menores de 5 años “más adelante en 2021”. La seguridad y la eficacia en personas de 12 a 15 años ya se están evaluando en un estudio global de fase 3 y está previsto presentar los datos pertinentes a las autoridades reguladoras “en el segundo trimestre de 2021”. Las compañías también están planeando estudios para evaluar más la vacuna en personas con sistemas inmunológicos comprometidos.
(Con información de Europa Press)
Las Más Vistas

Resultado positivo de los allanamientos por droga realizados en el Barrio Francisco II

Ricardo Quintela: "Milei maneja la plata como si fuera suya"

Por ahorro energético, la UNLaR establece nuevos horarios para la presencialidad

El padre del agresor que mató a seis personas en un shopping de Sídney señaló que "era un niño enfermo"
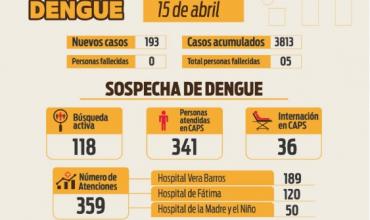
Emergencia Dengue: se reportaron 193 nuevos casos este lunes lo que hace un total de 3813
Top Semanal
TAMBIÉN TE PUEDE INTERESAR
LOCALES
NACIONALES
INTERNACIONES
DEPORTES
SOCIEDAD
FARÁNDULA